OXIDACIÓN: la oxidación es la reacción de alcoholes para
producir ácidos carboxílicos, cetonas o aldehídos dependiendo del tipo de
alcohol y de catalizador, puede ser:
La reacción de un alcohol primario con ácido crómico (CrO3) en presencia de piridina
produce un aldehído:
- La reacción de un alcohol primario en presencia del reactivo de jones produce un ácido carboxilo:
- la reacción de un alcohol secundario en presencia de permanganato de potasio produce una cetona:
DESHIDROGENACION: Los alcoholes primarios y secundarios cuando se calientan en contacto con ciertos catalizadores, pierden átomos de hidrógeno para formar aldehídos o cetonas. Si esta deshidrogenación se realiza en presencia de aire (O) el hidrógeno sobrante se combina con el oxígeno para dar agua.
HALOGENACION: el alcohol reacciona con el ácido hidrácido para formar haluros de alquilo mas agua:
R-OH + HX -------------------) R-X + H2O
DESHIDRATACION: es una propiedad de los alcoholes mediante la cual podemos obtener eteres o alquenos:
2 R -CH2OH ----------------) R - CH2 - O - CH2 - R'
R-R-OH ------------) R=R + H2O
PROPIEDADES FÍSICAS DE LOS ALCOHOLES
- SOLUBILIDAD EN EL AGUA: .Gracias al grupo -OH característico de los alcoholes, se pueden presentar puentes de hidrógeno, que hace que los primeros alcoholes sean solubles en el agua, mientras que a mayor cantidad de hidrógeno, dicha característica va desapareciendo debido a que el grupo hidroxilo va perdiendo significancia y a partir del hexanol la sustancia se torna aceitosa.
- PUNTO DE EBULLICIÓN: Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones. Todo esto se presenta porque el grupo OH al tener puentes de hidrógeno, son mas difíciles de romper.
- PUNTO DE FUSIÓN: Presenta el mismo comportamiento que el punto de ebullición aumenta a medida que aumenta el numero de carbonos.
- DENSIDAD: Aumenta conforme aumenta el numero de carbonos y las ramificaciones de las moléculas.
USOS
Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como disolventes y combustibles. El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y disponibilidad para disolver sustancias no polares, el etanol es utilizado frecuentemente como disolvente en fármacos, perfumes y en esencias vitales como la vainilla.
Los alcoholes sirven frecuentemente como versátiles intermediarios en la síntesis orgánica.
El isobutanol , un disolvente para revestimientos de superficie y adhesivos, se emplea en lacas, decapantes de pinturas, perfumes,productos de limpieza y líquidos hidráulicos.
El terc-butanol se utiliza para la eliminación del agua de los productos, como disolvente en la fabricación de fármacos, perfumes y aromas, y como producto químico intermedio. También es un ingrediente de productos industriales de alcohol, un desnaturalizante de alcoholes y un cebador de octano en gasolinas.
Los alcoholes amílicosactúan como espumígenos en la flotación de minerales. Muchos
El pentanol se utiliza en la fabricación de lacas, pinturas,barnices, decapantes, caucho, plásticos, explosivos, líquidos hidráulicos, pegamentos para calzado, perfumes, productos
Después del cloruro de alilo, el alcohol alílico es el compuestos alílico más importante en la industria. Se utiliza en la fabricación de productos farmacéuticos y en síntesis químicas en general, pero sobre todo para la producción de una serie de ésteres alílicos, los más importantes de los cuales son el ftalato de dialilo y el isoftalato de dialilo, que sirven de monómeros y repolímeros
BENEFICIOS Y RIESGOS DE LOS ALCOHOLES
Metanol
Entre los muchos procesos de síntesis que existen para la producción de alcohol metílico se encuentra la reacción de FischerTropsch entre el monóxido de carbono y el hidrógeno, de la que se obtiene metanol como subproducto. También se produce mediante la oxidación directa de hidrocarburos o mediante un proceso de hidrogenación en dos etapas en el que se hidrogena el monóxido de carbono para dar formiato de metilo, que a su vez se hidrogena para obtener alcohol metílico. Sin embargo, la síntesis más importante es la realizada mediante hidrogenación catalítica a presión del monóxido de carbono o del dióxido de
carbono, a presiones de 100-600 kgf/cm2 y temperaturas de 250-400 ºC. El alcohol metílico tiene propiedades tóxicas que pueden hacerse evidentes tanto por exposición aguda como crónica. Los alcohólicos que ingieren este líquido o los trabajadores que inhalan sus vapores pueden sufrir lesiones. En experimentos con animales se ha demostrado que el alcohol metílico puede penetrar en la piel en cantidad suficiente como para causar una intoxicación mortal. En casos de intoxicación grave, generalmente por ingestión, el
alcohol metílico actúa de forma específica en el nervio óptico,causando ceguera como resultado de la degeneración del nervio óptico, acompañada de cambios degenerativos en las células ganglionares de la retina y trastornos circulatorios en la coroides. La ambliopía es normalmente bilateral y puede aparecer pocas horas después de la ingestión, mientras que la ceguera total no se instaura hasta pasada una semana. Las pupilas aparecen dilatadas, la esclerótica congestionada y el iris está pálido y presenta escotoma central; las funciones respiratorias y cardiovasculares están deprimidas y, en los casos muy graves, el paciente está inconsciente, si bien el coma puede ir precedido de delirio.
Las consecuencias de la exposición industrial a los vapores de
alcohol metílico pueden variar considerablemente de un trabajador a otro. Bajo diferentes condiciones de intensidad y duración de la exposición, los síntomas de la intoxicación son: irritación de las mucosas, cefalea, zumbido de oídos, vértigo, insomnio, nistagmo, dilatación de las pupilas, visión borrosa, náuseas, vómitos, cólicos y estreñimiento. Pueden producirse lesiones cutáneo por la acción irritante y disolvente del alcohol metílico y también por la acción lesiva de los tintes y resinas disueltas en él. Estas lesiones se localizan preferentemente en las manos, las muñecas y los antebrazos. No obstante, la causa de estos efectos perjudiciales se debe en general a exposiciones prolongadas a concentraciones muy superiores a los límites recomendados por las autoridades para prevenir la intoxicación por inhalación de vapores de alcohol metílico. Se ha sugerido que la exposición crónica combinada a metanol y monóxido de carbono es un factor causante de aterosclerosis
cerebral. La acción tóxica del alcohol metílico se atribuye a oxidación
metabólica en ácido fórmico o formalizado , producto éste que tiene un efecto nocivo específico en el sistema nervioso, y posiblemente a acidosis grave. Estos procesos de oxidación pueden ser inhibidos por el alcohol etílico.
Etanol
Un riesgo industrial frecuente es la exposición a vapores en la proximidad de un proceso en el que se utiliza alcohol etílico. La exposición prolongada a concentraciones superiores a
5.000 ppm causa irritación de los ojos y la nariz, cefalea, sopor, fatiga y narcosis. El alcohol etílico se oxida muy rápidamente en el organismo a dióxido de carbono y agua. El alcohol no oxidado se excreta en la orina y en el aire espirado, de manera que apenas se producen efectos acumulativos. Su efecto en la piel es similar al de todos los disolventes de grasas y, de no tomarse las debidas precauciones, puede producirse una dermatitis de contacto. Recientemente se ha sospechado la existencia de otro riesgo potencial en las personas expuestas a etanol sintético, por haberse demostrado que este producto es cancerígeno en ratones tratados con dosis altas. Un estudio epidemiológico posterior ha revelado una mayor incidencia de cáncer de laringe (cinco veces superior a la prevista) en un grupo de trabajadores empleados en una fábrica de etanol obtenido mediante ácidos fuertes. Parece ser que el agente causal fue el sulfato de dietilo, aunque también
estaban implicados las alquil sulfonas y otros posibles cancerígenos. El alcohol etílico es un líquido inflamable y sus vapores forman mezclas inflamables y explosivas con el aire a temperatura ambiente. Una solución acuosa con un 30 % de alcohol puede producir una mezcla inflamable de vapor y aire a 29 ºC. Otra que contenga solamente un 5 % de alcohol puede producirla a 62 ºC. La ingestión es poco probable en el entorno industrial, pero
posible en el caso de los alcohólicos. El peligro de este consumo anómalo depende de la concentración de etanol, que si es superior al 70 % puede producir lesiones esofágicas y gástricas, y de la presencia de desnaturalizantes. Estos últimos se añaden para
hacer que el alcohol tenga un sabor desagradable cuando se obtiene libre de impuestos para fines distintos al del consumo. Muchos de estos desnaturalizantes (p. ej. alcohol metílico,
benceno, bases de piridina, metilisobutilcetona, queroseno, acetona, gasolina, dietilftalato, etc.) son más peligrosos para la persona que lo consuma que el propio alcohol etílico. Por todo
ello es muy importante asegurarse de que no se produce consumo ilegal de alcohol etílico destinado a usos industriales.
Los alcoholes sirven frecuentemente como versátiles intermediarios en la síntesis orgánica.
Los alcoholes se utilizan como productos químicos intermedios y disolventes en las industrias de textiles, colorantes, productos químicos, detergentes, perfumes, alimentos, bebidas, cosméticos,pinturas y barnices.
Algunos compuestos se utilizan también en la des naturalización del alcohol, en productos de limpieza, aceites y tintas de secado rápido, anticongelantes, agentes espumígenos y en la flotación de minerales.
Algunos compuestos se utilizan también en la des naturalización del alcohol, en productos de limpieza, aceites y tintas de secado rápido, anticongelantes, agentes espumígenos y en la flotación de minerales.
El n-propanol es un disolvente utilizado en lacas, cosméticos,lociones dentales, tintas de impresión, lentes de contacto y líquidos de frenos. También sirve como antiséptico, aromatizante sintético de bebidas no alcohólicas y alimentos, producto químico intermedio y desinfectante.
El isopropanol es otro disolvente industrial importante que se utiliza como anticongelante, en aceites y tintas de secado rápido, en la desnaturalización de alcoholes y en perfumes. Se emplea como antiséptico y sustitutivo del alcohol etílico en cosméticos (p. ej. lociones para la piel, tónicos
El isopropanol es otro disolvente industrial importante que se utiliza como anticongelante, en aceites y tintas de secado rápido, en la desnaturalización de alcoholes y en perfumes. Se emplea como antiséptico y sustitutivo del alcohol etílico en cosméticos (p. ej. lociones para la piel, tónicos
capilares y alcohol para fricciones), pero no puede utilizarse en productos farmacéuticos aplicados internamente.
El isopropanol es un ingrediente de jabones líquidos, limpiacristales, aromatizante sintético de bebidas no alcohólicas y alimentos y producto
El isopropanol es un ingrediente de jabones líquidos, limpiacristales, aromatizante sintético de bebidas no alcohólicas y alimentos y producto
químico intermedio
El n-butanol se emplea como disolvente de pinturas, lacas,barnices, resinas naturales y sintéticas, gomas, aceites vegetales,tintes y alcaloides. Se utiliza como sustancia intermedia en la fabricación de productos químicos y farmacéuticos, y en las industrias de cuero artificial, textiles, gafas de seguridad, pastas de caucho, barnices de laca, impermeables, películas fotográficas y perfumes
El sec-butanol se utiliza también como disolvente y producto químico intermedio, y se encuentra en líquidos hidráulicos de frenos, limpiadores industriales, abrillantadores, de pinturas, agentes de flotación para minerales, esencias de frutas, perfumes y colorantes.
El n-butanol se emplea como disolvente de pinturas, lacas,barnices, resinas naturales y sintéticas, gomas, aceites vegetales,tintes y alcaloides. Se utiliza como sustancia intermedia en la fabricación de productos químicos y farmacéuticos, y en las industrias de cuero artificial, textiles, gafas de seguridad, pastas de caucho, barnices de laca, impermeables, películas fotográficas y perfumes
El sec-butanol se utiliza también como disolvente y producto químico intermedio, y se encuentra en líquidos hidráulicos de frenos, limpiadores industriales, abrillantadores, de pinturas, agentes de flotación para minerales, esencias de frutas, perfumes y colorantes.
El isobutanol , un disolvente para revestimientos de superficie y adhesivos, se emplea en lacas, decapantes de pinturas, perfumes,productos de limpieza y líquidos hidráulicos.
El terc-butanol se utiliza para la eliminación del agua de los productos, como disolvente en la fabricación de fármacos, perfumes y aromas, y como producto químico intermedio. También es un ingrediente de productos industriales de alcohol, un desnaturalizante de alcoholes y un cebador de octano en gasolinas.
Los alcoholes amílicosactúan como espumígenos en la flotación de minerales. Muchos
alcoholes, entre ellos el alcohol metilamílico, 2-etilbutanol, 2-etilhexanol,ciclohexanol, 2-octanol y metilciclohexanol, se utilizan en la fabricación de lacas. Además de sus numerosas aplicaciones como disolventes, el ciclohexanol y el metilciclohexanol son también útiles en la industria textil.
El metanol es un disolvente de tintas, colorantes, resinas y adhesivos. Se utiliza en la fabricación de película fotográfica, plásticos, jabones textiles, tintes de madera, tejidos con capa de resina sintética, cristal inastillable y productos impermeabilizantes. Sirve como materia prima para la fabricación de muchos productos químicos y es un ingrediente de decapantes de pinturas
El metanol es un disolvente de tintas, colorantes, resinas y adhesivos. Se utiliza en la fabricación de película fotográfica, plásticos, jabones textiles, tintes de madera, tejidos con capa de resina sintética, cristal inastillable y productos impermeabilizantes. Sirve como materia prima para la fabricación de muchos productos químicos y es un ingrediente de decapantes de pinturas
y barnices, productos desengrasantes, líquidos embalsamadores y mezclas anticongelantes.
El pentanol se utiliza en la fabricación de lacas, pinturas,barnices, decapantes, caucho, plásticos, explosivos, líquidos hidráulicos, pegamentos para calzado, perfumes, productos
químicos y farmacéuticos, y en la extracción de grasas.
Cuando se utilizan como disolventes, sirven perfectamente las mezclas de
Cuando se utilizan como disolventes, sirven perfectamente las mezclas de
alcoholes, pero para síntesis químicas o extracciones más selectivas se requieren a menudo productos más puros.
Después del cloruro de alilo, el alcohol alílico es el compuestos alílico más importante en la industria. Se utiliza en la fabricación de productos farmacéuticos y en síntesis químicas en general, pero sobre todo para la producción de una serie de ésteres alílicos, los más importantes de los cuales son el ftalato de dialilo y el isoftalato de dialilo, que sirven de monómeros y repolímeros
BENEFICIOS Y RIESGOS DE LOS ALCOHOLES
Metanol
Entre los muchos procesos de síntesis que existen para la producción de alcohol metílico se encuentra la reacción de FischerTropsch entre el monóxido de carbono y el hidrógeno, de la que se obtiene metanol como subproducto. También se produce mediante la oxidación directa de hidrocarburos o mediante un proceso de hidrogenación en dos etapas en el que se hidrogena el monóxido de carbono para dar formiato de metilo, que a su vez se hidrogena para obtener alcohol metílico. Sin embargo, la síntesis más importante es la realizada mediante hidrogenación catalítica a presión del monóxido de carbono o del dióxido de
carbono, a presiones de 100-600 kgf/cm2 y temperaturas de 250-400 ºC. El alcohol metílico tiene propiedades tóxicas que pueden hacerse evidentes tanto por exposición aguda como crónica. Los alcohólicos que ingieren este líquido o los trabajadores que inhalan sus vapores pueden sufrir lesiones. En experimentos con animales se ha demostrado que el alcohol metílico puede penetrar en la piel en cantidad suficiente como para causar una intoxicación mortal. En casos de intoxicación grave, generalmente por ingestión, el
alcohol metílico actúa de forma específica en el nervio óptico,causando ceguera como resultado de la degeneración del nervio óptico, acompañada de cambios degenerativos en las células ganglionares de la retina y trastornos circulatorios en la coroides. La ambliopía es normalmente bilateral y puede aparecer pocas horas después de la ingestión, mientras que la ceguera total no se instaura hasta pasada una semana. Las pupilas aparecen dilatadas, la esclerótica congestionada y el iris está pálido y presenta escotoma central; las funciones respiratorias y cardiovasculares están deprimidas y, en los casos muy graves, el paciente está inconsciente, si bien el coma puede ir precedido de delirio.
Las consecuencias de la exposición industrial a los vapores de
alcohol metílico pueden variar considerablemente de un trabajador a otro. Bajo diferentes condiciones de intensidad y duración de la exposición, los síntomas de la intoxicación son: irritación de las mucosas, cefalea, zumbido de oídos, vértigo, insomnio, nistagmo, dilatación de las pupilas, visión borrosa, náuseas, vómitos, cólicos y estreñimiento. Pueden producirse lesiones cutáneo por la acción irritante y disolvente del alcohol metílico y también por la acción lesiva de los tintes y resinas disueltas en él. Estas lesiones se localizan preferentemente en las manos, las muñecas y los antebrazos. No obstante, la causa de estos efectos perjudiciales se debe en general a exposiciones prolongadas a concentraciones muy superiores a los límites recomendados por las autoridades para prevenir la intoxicación por inhalación de vapores de alcohol metílico. Se ha sugerido que la exposición crónica combinada a metanol y monóxido de carbono es un factor causante de aterosclerosis
cerebral. La acción tóxica del alcohol metílico se atribuye a oxidación
metabólica en ácido fórmico o formalizado , producto éste que tiene un efecto nocivo específico en el sistema nervioso, y posiblemente a acidosis grave. Estos procesos de oxidación pueden ser inhibidos por el alcohol etílico.
Etanol
Un riesgo industrial frecuente es la exposición a vapores en la proximidad de un proceso en el que se utiliza alcohol etílico. La exposición prolongada a concentraciones superiores a
5.000 ppm causa irritación de los ojos y la nariz, cefalea, sopor, fatiga y narcosis. El alcohol etílico se oxida muy rápidamente en el organismo a dióxido de carbono y agua. El alcohol no oxidado se excreta en la orina y en el aire espirado, de manera que apenas se producen efectos acumulativos. Su efecto en la piel es similar al de todos los disolventes de grasas y, de no tomarse las debidas precauciones, puede producirse una dermatitis de contacto. Recientemente se ha sospechado la existencia de otro riesgo potencial en las personas expuestas a etanol sintético, por haberse demostrado que este producto es cancerígeno en ratones tratados con dosis altas. Un estudio epidemiológico posterior ha revelado una mayor incidencia de cáncer de laringe (cinco veces superior a la prevista) en un grupo de trabajadores empleados en una fábrica de etanol obtenido mediante ácidos fuertes. Parece ser que el agente causal fue el sulfato de dietilo, aunque también
estaban implicados las alquil sulfonas y otros posibles cancerígenos. El alcohol etílico es un líquido inflamable y sus vapores forman mezclas inflamables y explosivas con el aire a temperatura ambiente. Una solución acuosa con un 30 % de alcohol puede producir una mezcla inflamable de vapor y aire a 29 ºC. Otra que contenga solamente un 5 % de alcohol puede producirla a 62 ºC. La ingestión es poco probable en el entorno industrial, pero
posible en el caso de los alcohólicos. El peligro de este consumo anómalo depende de la concentración de etanol, que si es superior al 70 % puede producir lesiones esofágicas y gástricas, y de la presencia de desnaturalizantes. Estos últimos se añaden para
hacer que el alcohol tenga un sabor desagradable cuando se obtiene libre de impuestos para fines distintos al del consumo. Muchos de estos desnaturalizantes (p. ej. alcohol metílico,
benceno, bases de piridina, metilisobutilcetona, queroseno, acetona, gasolina, dietilftalato, etc.) son más peligrosos para la persona que lo consuma que el propio alcohol etílico. Por todo
ello es muy importante asegurarse de que no se produce consumo ilegal de alcohol etílico destinado a usos industriales.
PROPIEDADES FÍSICAS DE LOS ETERES
Son compuestos que resultan de la unión de dos radicales alquílicos o aromáticos a través de un puente de oxígeno -O-. son compuestos que tienen un átomo de oxígeno unido a dos radicales hidrocarbonados
Se nombran interponiendo la partícula "-oxi-" entre los dos radicales, o más comunmente, nombrando los dos radicales por orden alfabético, seguidos de la palabra "éter".
Los éteres presentan unos puntos de ebullición inferiores a los alcoholes, aunque su solubilidad en agua es similar. Dada su importante estabilidad en medios básicos, se emplean como disolventes inertes en numerosas reacciones.
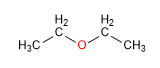
La importante solubilidad en agua se explica por los puentes de hidrógeno que se establecen entre los hidrógenos del agua y el oxígeno del éter.
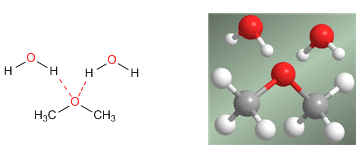
1. Éteres a partir de alcoholes primarios
Los éteres simétricos pueden prepararse por condensación de alcoholes. La reacción se realiza bajo calefacción (140ºC) y con catálisis ácida. Así, dos moléculas de etanol condensan para formar dietil éter.
- Estructural mente los éteres pueden considerarse derivados del agua o alcoholes, en los que se han reemplazado uno o dos hidrógenos, respectivamente, por restos carbonados.
![[small][AnimePaper]wallpapers_Ergo-Proxy_Tenken-the-2nd(1_33)__THISRES__73653 [small][AnimePaper]wallpapers_Ergo-Proxy_Tenken-the-2nd(1_33)__THISRES__73653](http://kira2629.files.wordpress.com/2009/06/smallanimepaperwallpapers_ergo-proxy_tenken-the-2nd1_33__thisres__73653.jpg?w=477&h=86)
-
La estructura angular de los éteres se explica bien asumiendo una hibridación sp3 en el oxígeno, que posee dos pares de electrones no compartidos,no puede establecer enlaces de hidrógeno consigo mismo y sus puntos de ebullición y fusión son muchos más bajos que los alcoholes referibles.
Un caso muy especial lo constituyen los epóxidos, que son éteres cíclicos de tres miembros. El anillo contiene mucha tensión, aunque algo menos que en el ciclo propano.
Ciclo propano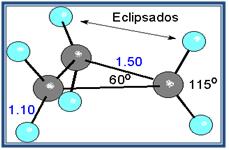

Epóxido de etileno
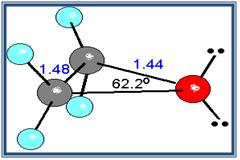
- Debido a que el ángulo del enlace C-o-C no es de 180º, los momentos dipolares de los dos enlaces C-O no se anulan; en consecuencia, los éteres presentan un pequeño momento dipolar neto (por ejemplo, 1.18 D para el dietil éter).
PROPIEDADES QUÍMICAS DE LOS ETERES
Los éteres tienen muy poca reactividad química, debido a la dificultad que presenta la ruptura del enlace C—O. Por ello, se utilizan mucho como disolventes inertes en reacciones orgánicas. En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación .
REACCIONES
Los éteres no son reactivos a excepción de los epóxidos.Las reacciones de los epóxidos pasan por la apertura del ciclo.Dicha apertura puede ser catalizada por ácido o apertura mediante nucleófilo.
- Apertura catalizada por ácido

El nucleófilo ataca al carbono más sustituido.
Apertura por nucleófilo

El nucleófilo ataca al carbono menos sustituido.
USOS DE LOS ETERES EN LA INDUSTRIA
Medio de arrastre para la deshidratacion de alcoholes isopropilicos y etílicos.
Disolvente de sustacias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides).
Combustible inicial de motores diésel.
Fuertes pegamentos.
Antinflamatorio abdominal para después del parto, solo uso externo.
Anestésicos
Los esteres son los que dan olor y sabor a muchas frutas y es por eso que son utilizados para hacer esencias, aromatizantes y perfumes. Las moléculas de éster contienen un grupo carbonilo unido a un grupo -OR. Es conveniente considerar un éster en términos de un ácido y un alcohol precursores que podrían reaccionar para producir ese éster. La parte ácida de un éster incluye el grupo carbonilo y un átomo de hidrógeno, un grupo alquilo o un grupo arilo. La parte alcohólica de un éster incluye el grupo -OR.
Aplicaciones en la medicina
Los ésteres de ácidos salicílico se utilizan en medicina. Ejemplo:
ácido acetil salicílico fue introducida en la clínica en 1899 siendo utilizada como analgésico, anti-inflamatorio, antipirético y antitrombótico. Una vez en el organismo, el ácido acetilsalicíco es hidrolizado a salicilato, que también es activo. Las propiedades analgésicas y anti-inflamatorias del ácido acetil-salicílico son parecidas a las de otros anti-inflamatorios no esteroídicos. El ácido acetilsalicílico es utilizado en el tratamiento de numerosas condiciones inflamatorias y auto inmunes como la artritis juvenil, la artritis reumatoidea, y la osteoartritis. Por sus propiedades antitrombóticas se utiliza para prevenir o reducir el riesgo de infarto de miocardio y de ataques transitorios de isquemia. Durante la mayor parte del siglo XX, la aspirina fué utilizada como analgésico y anti-inflamatorio, pero a partir de 1980 se puso de manifiesto su capacidad para inhibir la agregación plaquetaria, siendo utilizada cada vez más para esta indicación. Más recientemente se ha demostrado que el tratamiento crónico con ácido acetilsalicílico (más de 10 años) reduce el riesgo de cáncer de colon. Se sabe hoy día que la aspirina posee propiedades antiproliferativas.
- salicilato de metilo que está indicado para el alivio sintomático de alteraciones músculo esqueléticas, de articulaciones y tejidos blandos como dolores reumáticos, contusiones, esguinces, contracturas, tendinitis, etc., para lo cual se usa en concentraciones del 10-25%. También forma parte de formulaciones destinadas a inhalaciones, para el alivio sintomático de alteraciones del tracto respiratorio superior. Se usa en preparados en forma de cremas y pomadas en concentraciones del 10 al 25%. Se debe conservar protegido de la luz.

- salicilato de fenilo es un antiséptico estomacal de uso muy amplio. Los ácidos no lo hidrolizan y, por lo tanto, pasa a través del estómago sin cambios. En el medio alcalino intestinal, ocurre la hidrólisis a fenol y salicilato. También se emplea como capa entérica para algunas píldoras medicinales a fin de permitir su paso a través del estómago intactas y desintegrarse en el intestino.

BENEFICIOS Y RIESGOS PARA LA SALUD
Anestesia significa insensibilidad al dolor. Las sustancias con propiedad anestésica inducen generalmente la depresión del sistema nervioso central. Por ello, al aplicarlas, debe tenerse mucho cuidad con su concentración pero sobre todo con la cantidad que se suministra al paciente. En gran medida, la medicina se dedica al tratamiento de los síntomas y, de éstos, el dolor tal vez es el más importante. Entender plenamente las causas y la manera de controlar el dolor sigue siendo un reto para los científicos. Este camino se inició en 1846, cuando el dentista bostoniano William Morton utilizó por primera vez el éter di etílico como anestésico. Antes de este hecho la cirugía no solo provocaba una cantidad importante de muertes por la ausencia de desinfectantes sino que, al ser extraordinariamente dolorosa causaba también decesos pro el trauma resultante. El éter di etílico es un buen anestésico. Es seguro para el paciente, ya que el pulso cardíaco y respiratorio, así como la presión arterial, permanecen normales durante su aplicación, la cual además es muy sencilla. Sus desventajas estriban en los efectos lateral que produce, como náuseas e irritación de las vías respiratorias. Otro inconveniente es su alta volatilidad e inflamabilidad lo que ha dado lugar a la búsqueda de otras sustancias que mantengas sus ventajas, pero reduzcan sus inconvenientes. Entre los éteres más utilizados tenemos al divinil éter, el metil propil éter y el enfluorano. Otros compuestos que no son éteres pero que tienen ésta propiedad son el ciclo propano (empleado en las operaciones como anestésico mezclado con un 30% de helio), el halotano y el dióxido de nitrógeno, llamado también gas de la risa. El primer anestésico local efectivo e inyectable, empleado inicialmente a finales del siglo pasado, fue la cocaína. Después de un tiempo se descubrió que su uso producía dependencia física (se trata de una deroga). Del estudio de sus propiedades se sintetizo en 1904 otro poderoso anestésico, la novocaína, y posteriormente la xilocaína que se usan hasta nuestros días.
PROPIEDADES FÍSICAS DE LOS ESTERES
Los Ésteres son compuestos orgánicos derivados de ácidos orgánicos o inorgánicos oxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R').
Etimológicamente, la palabra "éster" proviene del alemán Essig-Äther (éter de vinagre), como se llamaba antiguamente al acetato de etilo.1
En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es elácido acético, el éster es denominado como acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico delácido sulfúrico".
Los ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden participar como donadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las ilimitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como donador de enlace de hidrógeno ocasiona el que no pueda formar enlaces de hidrógeno entre moléculas de ésteres, lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
Los que son de bajo peso molecular son líquidos volátiles de olor agradable. Son las responsables de los olores de ciertas frutas.
Los ésteres superiores son sólidos cristalinos, inodoros. Solubles en solventes orgánicos e insolubles en agua. Son menos densos que el agua.
Combinando anhídridos con alcoholes.
PROPIEDADES QUÍMICAS DE LOS ESTERES
Los ésteres se pueden hidrolizar a su ácido y su alcohol precursores. Recordemos que en la reacción de hidrólisis, una molécula de agua se rompe y se adiciona a otra molécula. Para aumentar la velocidad de las reacciones de hidrólisis de los ésteres se agregan ácidos o bases inorgánicas y se calienta la mezcla. La hidrólisis de un éster ocurre de la siguiente forma:

Si los ésteres se hidrolizan en una solución alcalina, la reacción de hidrólisis se denomina saponificación. El término saponificación significa fabricación de jabón. Los jabones, o sea las sales solubles de los ácidos grasos, se preparan calentando las grasas de plantas o animales en una solución básica de alcohol y agua.

En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones, es la reacción inversa a la esterificación.
Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol (Reducción de Bouveault-Blanc). El hidruro de litio y aluminio reduce ésteres de ácidos carboxílicos para dar 2 equivalentes de alcohol.2 La reacción es de amplio espectro y se ha utilizado para reducir diversos ésteres. Las lactonas producen dioles. Existen diversos agentes reductores alternativos al hidruro de litio y aluminio como el DIBALH, el trietil-borohidruro de litio o BH3–SiMe3reflujado con THF.3
El dicloruro de titanoceno reduce los ésteres de ácidos carboxílicos hasta el alcano (RCH3)y el alcohol R-OH.4 El mecanismo probablemente se debe a la formación de un alqueno intermediario.
El hidrógeno α de muchos ésteres puede ser sustraído con una base no nucleofílica o el alcóxido correspondiente al éster. El carbanión generado puede unirse a diversos sustratos en diversas reacciones de condensación, tales como la condensación de Claisen , la Condensación de Dieckmann y la síntesis malónica. Muchos métodos de síntesis de anillos heterocíclicos aprovechan estas propiedades químicas de los ésteres, tales como la síntesis de pirroles de Hantzsch y la síntesis de Feist-Benary.
Existen reacciones de condensación en las que se utiliza un reductor que aporte electrones para formar el enlace C-C entre grupos acilo, como el caso de la condensación aciloínica. Los ésteres pueden dar alcoholes con dos sustituyentes idénticos por adición de reactivos de Grignard. Unas aplicación de esta reacción es la reacción de Fujimoto-Belleau.
USOS
La mejor aplicación es utilizarlo en esencias para dulces y bebidas. Otros para preparar perfumes. Otros como antisépticos, como el cloruro de etilo.
Formiato de etilo: esencia de grosella, ron
Acetato de etilo: esencia de manzana y pera. Solvente de la nitrocelulosa.
Butirato de etilo: esencia de durazno.
Acetato de butilo: solvente de la nitrocelulosa. Lacas; barnices; plásticos; vidrios de seguridad; perfumes.
Acetato de amilo: solvente de lacas y barnices
Acetato de etilo: esencia de manzana y pera. Solvente de la nitrocelulosa.
Butirato de etilo: esencia de durazno.
Acetato de butilo: solvente de la nitrocelulosa. Lacas; barnices; plásticos; vidrios de seguridad; perfumes.
Acetato de amilo: solvente de lacas y barnices
Los ésteres de ácidos salicílico se utilizan en medicina. Ejemplo: el ácido acetil salicílico (aspirina), el salicilato de metilo y el salicilato de fenilo.

BENEFICIOS Y RIESGOS PARA LA SALUD
Los ésteres etílicos del ácido omega 3 se utilizan junto con cambios en el estilo de vida (dieta, adelgazamiento y ejercicio) para reducir la cantidad de triglicéridos (sustancias grasas) en la sangre. Los ésteres etílicos del ácido omega 3 pertenecen a una clase de medicamentos denominados agentes antilipémicos o reguladores de los lípidos. Es posible que los ésteres etílicos del ácido omega 3 actúen al reducir la cantidad de triglicéridos y otras grasas que se producen en el hígado.
Etil Esteres
Los etil ésteres son una forma alternativa de grasas que son derivadas al reaccionar ácido grasos libres con etanol. Durante este proceso, algunos ácidos grasos son separados de su columna natural de glicerol y vinculados a una molécula de etanol. En este proceso llamado trans‐esterificación se producen los etil ésteres de aceite de pescado (fish oil EE).
Los ácidos carboxílicos son compuestos de gran importancia para el hombre, ya que, además de estar presentes en los alimentos que contienen las proteínas desdobladas por el cuerpo humano para aprovechar su energía, están presentes en procesos fundamentales del organismo, como lo es, por ejemplo, el ciclo de Krebs, esto se debe a que los ácidos carboxílicos forman parte de todos los ácidos participantes en este proceso, como por ejemplo el ácido fumárico; además de ser parte de algunas moléculas importantes para el organismo, tales como los aminoácidos, los cuales son participantes en la síntesis de proteínas del cuerpo.
Los disolventes y las tintas son los productos químicos que con mas frecuencia se utilizan el Sector de Artes de Gráficas, dado que alguno de estos productos pueden ser sumamente peligrosos para la salud y hasta mortales
cuando se utilizan sin las precauciones adecuadas, el conocimiento previo
de los riesgos que conlleva su utilización, así como un sistema eficaz de
seguridad y salud constituyen la mejor prevención y protección de los trabajadores frente a éstos riesgos.
http://es.wikipedia.org/wiki/%C3%89ster#Propiedades_qu.C3.ADmicas
http://medicina.usac.edu.gt/quimica/acarb/Esteres.htm
http://www.quimicayalgomas.com/quimica-organica/esteres
http://quimicaparatodos.blogcindario.com/2009/09/00077-los-esteres.html
http://jorge8591.blogspot.com/2013/07/alcoholes-eteres-etere.html
http://medicina.usac.edu.gt/quimica/acarb/Esteres.htm
http://www.quimicayalgomas.com/quimica-organica/esteres
http://quimicaparatodos.blogcindario.com/2009/09/00077-los-esteres.html
http://jorge8591.blogspot.com/2013/07/alcoholes-eteres-etere.html
http://alcoholesquimica.blogspot.com/2010/11/propiedades-quimicas-de-los-alcoholes.html
http://alcoholesquimica.blogspot.com/2010/10/propiedades-fisicas-de-los-alcoholes_22.html
wikipedia







.jpg)
.jpg)

.jpg)

.jpg)


No hay comentarios:
Publicar un comentario