QUIMICA ORGANICA
Presentado por: Yurani lisbeth vesga diaz Grado:11-3 T
domingo, 20 de octubre de 2013
martes, 3 de septiembre de 2013
ACIDOS CARBOXILICOS
ÁCIDOS CARBOXILICOS
El comportamiento químico de los ácidos carboxílicos esta determinado por el grupo carboxilo -COOH. Esta función consta de un grupo carbonilo (C=O) y de un hidroxilo (-OH). Donde el -OH es el que sufre casi todas las reacciones: pérdida de protón (H+) o reemplazo del grupo –OH por otro grupo.
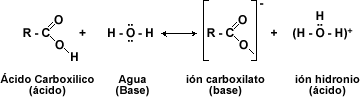
Los ácidos carboxílicos pueden ser desprotonados para formar aniones, los cuales son buenos nucleófilos en las reacciones SN2. Los ácidos carboxílicos experimentan ataques nucleófilos en su grupo carbonilo.
Las reacciones de los ácidos carboxílicos pueden agruparse en: sustitución, descarboxilación, desprotonación, reducción y sustitución nucleófila en el acilo.
PROPIEDADES FÍSICAS
Sus estructuras hacen suponer que los ácidos carboxílicos sean moléculas polares y , tal como los alcoholes, pueden formar puentes de hidrógeno entre sí y con otros tipos de moléculas. Los ácidos carboxílicos se comportan en forma similar a los alcoholes en cuanto a sus solubilidades : los primeros cuatro son miscibles con agua, el ácido de cinco carbonos es parcialmente soluble y los superiores son virtualmente insolubles
Los ácidos carboxílicos son solubles en solventes menos polares, tales como éter, alcohol, benceno, etc. Los ácidos carboxílicos hierven a temperaturas aún más altas que los alcoholes. Estos puntos de ebullición tan elevados se deben a que un par de moléculas del ácido carboxílico se mantienen unidas no por un puente de hidrógeno sino por dos.
Debido a la fácil interconversión de ácidos y sus sales, este comportamiento puede emplearse de dos modos importantes: para identificación y para separación.
usos
se utilizan los ácidos carboxilicos como emulsificantes, se usan especialmente para pH bajos, debido a su estabilidad en estas condiciones.
Además se usan como antitranspirantes y como neutralizantes, también para fabricar detergentes biodegradables, lubricantes y espesantes para pinturas. El ácido esteárico se emplea para combinar caucho o hule con otras sustancias, como pigmentos u otros materiales que controlen la flexibilidad de los productos derivados del caucho; también se usa en la polimerización de estireno y butadieno para hacer caucho artificial. Entre los nuevos usos de los ácidos grasos se encuentran la flotación de menas y la fabricación de desinfectantes, secadores de barniz y estabilizadores de calor para las resinas de vinilo. Los ácidos grasos se utilizan también en productos plásticos, como los recubrimientos para madera y metal, y en los automóviles, desde el alojamiento del filtro de aire hasta la tapicería.
ventajas y desventajas
El Acido Metanoico o Formico es el veneno de las hormigas
El Acido Butanoico o Butirico es propio de las mantequillas y le confiere ese sabor.
El Acido Etanoico o acetico es el bendito vinagre ni que decir mas.
El Acido Propanoico o Propionico es fermentador.
Acido Pentanoico o Acido Valerianico es la sustancia activa de la valeriana que es buena medicina para los nervios.
El Acido Tricarboxilico es la Vitamina C.
desventajas:
Hay estudios en los cuales indican que cuando hay fraccionamiento de las ligaduras químicas hay formación de compuestos oxigenados (aldehidos, ácidos carboxílicos y cetonas) los cuales tornan el producto levemente ácido, ese sería una desventaja para tal tecnología, ¿como eliminiarias esta desventaja?
bibliográfia
http://acidoscarboxilicosporchristiande11a.blogspot.com/p/usos-o-aplicaciones.html
http://acidoscarb.blogspot.es/1296014123/
http://html.rincondelvago.com/acidos-carboxilicos_4.html
Debido a la fácil interconversión de ácidos y sus sales, este comportamiento puede emplearse de dos modos importantes: para identificación y para separación.
| Nombre trivial | Nombre IUPAC | Estructura | Número de carbonos |
|---|---|---|---|
| Ácido fórmico | Ácido metanoico | HCOOH | C1:0 |
| Ácido acético | Ácido etanoico | CH3COOH | C2:0 |
| Ácido propiónico | Ácido propanoico | CH3CH2COOH | C3:0 |
| Ácido butírico | Ácido butanoico | CH3(CH2)2COOH | C4:0 |
| Ácido valérico | Ácido pentanoico | CH3(CH2)3COOH | C5:0 |
| Ácido caproico | Ácido hexanoico | CH3(CH2)4COOH | C6:0 |
| Ácido enántico | Ácido heptanoico | CH3(CH2)5)COOH | C7:0 |
| Ácido caprílico | Ácido octanoico | CH3(CH2)6COOH | C8:0 |
| Ácido pelargónico | Ácido nonanoico | CH3(CH2)7COOH | C9:0 |
| Ácido cáprico | Ácido decanoico | CH3(CH2)8COOH | C10:0 |
| Ácido undecílico | Ácido undecanoico | CH3(CH2)9COOH | C11:0 |
usos
se utilizan los ácidos carboxilicos como emulsificantes, se usan especialmente para pH bajos, debido a su estabilidad en estas condiciones.
Además se usan como antitranspirantes y como neutralizantes, también para fabricar detergentes biodegradables, lubricantes y espesantes para pinturas. El ácido esteárico se emplea para combinar caucho o hule con otras sustancias, como pigmentos u otros materiales que controlen la flexibilidad de los productos derivados del caucho; también se usa en la polimerización de estireno y butadieno para hacer caucho artificial. Entre los nuevos usos de los ácidos grasos se encuentran la flotación de menas y la fabricación de desinfectantes, secadores de barniz y estabilizadores de calor para las resinas de vinilo. Los ácidos grasos se utilizan también en productos plásticos, como los recubrimientos para madera y metal, y en los automóviles, desde el alojamiento del filtro de aire hasta la tapicería.
ventajas y desventajas
El Acido Metanoico o Formico es el veneno de las hormigas
El Acido Butanoico o Butirico es propio de las mantequillas y le confiere ese sabor.
El Acido Etanoico o acetico es el bendito vinagre ni que decir mas.
El Acido Propanoico o Propionico es fermentador.
Acido Pentanoico o Acido Valerianico es la sustancia activa de la valeriana que es buena medicina para los nervios.
El Acido Tricarboxilico es la Vitamina C.
desventajas:
Hay estudios en los cuales indican que cuando hay fraccionamiento de las ligaduras químicas hay formación de compuestos oxigenados (aldehidos, ácidos carboxílicos y cetonas) los cuales tornan el producto levemente ácido, ese sería una desventaja para tal tecnología, ¿como eliminiarias esta desventaja?
bibliográfia
http://acidoscarboxilicosporchristiande11a.blogspot.com/p/usos-o-aplicaciones.html
http://acidoscarb.blogspot.es/1296014123/
http://html.rincondelvago.com/acidos-carboxilicos_4.html
lunes, 12 de agosto de 2013
ALDEHÍDOS Y CETONAS
ALDEHÍDOS
Propiedades químicas
Se oxidan con facilidad transformándose en los ácidos carboxílicos respectivos. El carácter reductor de los aldehídos se verifica con la reacción de Tollens (nitrato de plata amoniacal); los productos de esta reacción son el ácido respectivo y un vistoso espejo de plata que permite identificar al grupo.
El grupo carbonilo de los aldehídos es fuertemente reactivo y participa en una amplia variedad de importantes transformaciones , sus reacciones mas importantes serian:
Reducción a alcoholes:
Por contacto con hidrógenos en presencia de ciertos catalizadores el doble enlace carbono=oxigeno del grupo carbonilo se rompe y un átomo de hidrógeno se acopla a uno de los enlaces para formar el grupo hidroxilo típico de los alcoholes.

Reducción a hidrocarburos:
Los aldehídos pueden ser reducidos a hidrocarburos al interactuar con cierto reactivos y en presencia de
catalizadores ;En la reducción Wolff-Kishner el acetaldehído se trata con hidracina como agente reductor y
etoxido de sodio como catalizador. El resultado de la reacción produce una mezcla etano, agua nitrógeno.

Polimerización:
Los primeros aldehídos dela clase tienen una marcada tendencia a polimerizar.
El formaldehido por ejemplo, polimeriza de forma espontanea a temperatura ligeramente superior a la de congelación (-92ºC).Del mismo, cuando se evapora una solución al 37% de formaldehido en agua que contenga 10 a 15% de metanol se produce un polímero solido que se conoce como para formar aldehído, si se calienta este se vuelve a ser formar aldehído en forma gaseosa.
Reacciones de adición:
Los aldehídos también sufren reacciones de adición, en las se rompe la estructura molecular del aldehído y el agente reaccionan se agrega a la molécula para formación de un nuevo compuesto.

Propiedades físicas
Por contacto con hidrógenos en presencia de ciertos catalizadores el doble enlace carbono=oxigeno del grupo carbonilo se rompe y un átomo de hidrógeno se acopla a uno de los enlaces para formar el grupo hidroxilo típico de los alcoholes.

Reducción a hidrocarburos:
Los aldehídos pueden ser reducidos a hidrocarburos al interactuar con cierto reactivos y en presencia de
catalizadores ;En la reducción Wolff-Kishner el acetaldehído se trata con hidracina como agente reductor y
etoxido de sodio como catalizador. El resultado de la reacción produce una mezcla etano, agua nitrógeno.

Polimerización:
Los primeros aldehídos dela clase tienen una marcada tendencia a polimerizar.
El formaldehido por ejemplo, polimeriza de forma espontanea a temperatura ligeramente superior a la de congelación (-92ºC).Del mismo, cuando se evapora una solución al 37% de formaldehido en agua que contenga 10 a 15% de metanol se produce un polímero solido que se conoce como para formar aldehído, si se calienta este se vuelve a ser formar aldehído en forma gaseosa.
Reacciones de adición:
Los aldehídos también sufren reacciones de adición, en las se rompe la estructura molecular del aldehído y el agente reaccionan se agrega a la molécula para formación de un nuevo compuesto.

Propiedades físicas
La doble unión del grupo carbonilo son en parte covalentes y en parte iónicas dado que el grupo carbonilo está polarizado debido al fenómeno de resonancia.
Los aldehídos con hidrógeno sobre un carbono sp³ en posición alfa al grupo carbonilo presentan isomería tautomérica Los aldehídos se obtienen de la deshidratación de un alcohol primario, se deshidratan con permanganato de potasio, la reacción tiene que ser débil , las cetonas también se obtienen de la deshidratación de un alcohol , pero estas se obtienen de un alcohol secundario e igualmente son deshidratados con permanganato de potasio y se obtienen con una reacción débil , si la reacción del alcohol es fuerte el resultado será un ácido carboxílico.
USOS
| Número de carbonos | Nomenclatura IUPAC | Nomenclatura trivial | Fórmula | P.E.°C |
|---|---|---|---|---|
| 1 | Metanal | Formaldehído | HCHO | -21 |
| 2 | Etanal | Acetaldehído | CH3CHO | 20,2 |
| 3 | Propanal | Propionaldehído Propilaldehído | C2H5CHO | 48,8 |
| 4 | Butanal | n-Butiraldehído | C3H7CHO | 75,7 |
| 5 | Pentanal | n-Valeraldehído Amilaldehído n-Pentaldehído | C4H9CHO | 103 |
| 6 | Hexanal | Capronaldehído n-Hexaldehído | C5H11CHO | |
| 7 | Heptanal | Enantaldehído Heptilaldehído n-Heptaldehído | C6H13CHO | |
| 8 | Octanal | Caprilaldehído n-Octilaldehído | C7H15CHO | |
| 9 | Nonanal | Pelargonaldehído n-Nonilaldehído | C8H17CHO | |
| 10 | Decanal | Caprinaldehído n-Decilaldehído | C9H19CHO |
USOS
Los aldehídos se utilizan principalmente para la fabricación de resinas, Plásticos, Solventes, Pinturas, Perfumes, Esencias.
Los aldehídos están presentes en numerosos productos naturales y grandes variedades de ellos son de la propia vida cotidiana. La glucosa por ejemplo existe en una forma abierta que presenta un grupo aldehído. El acetaldehído formado como intermedio en la metabolización se cree responsable en gran medida de los síntomas de la resaca tras la ingesta de bebidas alcohólicas.
El formaldehído es un conservante que se encuentra en algunas composiciones de productos cosméticos. Sin embargo esta aplicación debe ser vista con cautela ya que en experimentos con animales el compuesto ha demostrado un poder cancerígeno. También se utiliza en la fabricación de numerosos compuestos químicos como la baquelita, la melamina etc.
BENEFICIOS Y RIESGOS PARA LA SALUD
Los dos efectos más importantes de los aldehídos son: narcotizantes e irritantes.
Los aldehídos están presentes en numerosos productos naturales y grandes variedades de ellos son de la propia vida cotidiana. La glucosa por ejemplo existe en una forma abierta que presenta un grupo aldehído. El acetaldehído formado como intermedio en la metabolización se cree responsable en gran medida de los síntomas de la resaca tras la ingesta de bebidas alcohólicas.
El formaldehído es un conservante que se encuentra en algunas composiciones de productos cosméticos. Sin embargo esta aplicación debe ser vista con cautela ya que en experimentos con animales el compuesto ha demostrado un poder cancerígeno. También se utiliza en la fabricación de numerosos compuestos químicos como la baquelita, la melamina etc.
BENEFICIOS Y RIESGOS PARA LA SALUD
Los dos efectos más importantes de los aldehídos son: narcotizantes e irritantes.
El glutaraldehido se usa como: desinfectante en frío y el curtido de pieles. Es causante de dermatitis alérgicas.
Los principales efectos del formaldehido son: irritación de las vías respiratorias y ojos y dermatitis (las resinas). El NIOSH lo ha propuesto como potencialmente cancerígeno (ca. nasal en ratas).
En los RPA para puestos de trabajo con exposición a formaldehido, se descartarán: personas con alteraciones respiratorias y cutáneas.
El aldehído vanílico (vainilla) se usa en: industria de alimentación y perfumería.
El principal riesgo de la vainilla es: la dermatitis que produce en los trabajadores que la cultivan (en algunos países está considerada como enfermedad profesional). El acetaldehido se comporta como: irritante de mucosas y membranas, actuando también como narcótico sobre el SNC.
El acetaldehido se encuentra en sangre como: metabolito del alcohol etílico y se ve potenciado por disulfiram, cianamida y dimetilforfamida (efecto antabús). La exposición repetida a vapores de acetaldehido causa: dermatitis y conjuntivitis.
El principal riesgo de la vainilla es: la dermatitis que produce en los trabajadores que la cultivan (en algunos países está considerada como enfermedad profesional). El acetaldehido se comporta como: irritante de mucosas y membranas, actuando también como narcótico sobre el SNC.
El acetaldehido se encuentra en sangre como: metabolito del alcohol etílico y se ve potenciado por disulfiram, cianamida y dimetilforfamida (efecto antabús). La exposición repetida a vapores de acetaldehido causa: dermatitis y conjuntivitis.
PROPIEDADES QUÍMICAS
Al hallarse el grupo carbonilo en un carbono secundario son menos reactivas que los aldehídos. Sólo pueden ser oxidadas por oxidantes fuertes como el permanganato de potasio, dando como productos dos ácidos con menor número de átomos de carbono. Por reducción dan alcoholes secundarios. No reaccionan con el reactivo de Tollens para dar el espejo de plata como los aldehídos, lo que se utiliza para diferenciarlos. Tampoco reaccionan con los reactivos de Fehling y Schiff.
Al igual que los aldehídos, las cetonas pueden adicionar átomos de hidrógeno en presencia de catalizadores.
Adición de sulfito ácido de sodio:
Adición de ácido cianhídrico:
Oxidación: Los aldehídos se oxidan con facilidad. En presencia de un oxidante fuerte y calor, se rompe la cadena a la altura del grupo funcional y se forman dos moléculas de ácido.
Reacciones de sustitución:
Con halógenos dan reacciones de sustitución:
La Halogenación puede continuar hasta llegar al tricloro-1,1,1-propanona.
Las cetonas como los aldehídos presentan un fenómeno que se denomina tautomería. Básicamente es una transformación intramolecular que experimentan solo algunas sustancias. En este caso se llama tautomería cetoenólica.
Condensación: Al igual que los aldehídos, las cetonas experimentan un proceso de condensación entre sus moléculas.
propiedades físicas
Los aldehídos y cetonas se comportan como ácidos debido a la presencia del grupo carbonilo, esto hace que presenten reacciones típicas de adición nucleofílica.
Reacciones de adición nucleofílica: Estas reacciones se producen frente al (reactivo de Grignard), para dar origen a un oxihaluro de alquil-magnesio que al ser tratado con agua da origen a un alcohol. El metanal forma alcoholes primarios y los demás aldehídos forman alcoholes secundarios.


La reacción de adición nucleofílica en las cetonas dan origen a alcoholes terciarios.


Otras reacciones de adición nucleofílica pueden producirse con el ácido cianhídrico, el sulfito ácido de sodio, la hidroxilamina, hidracina, semicarbacida, fenilhidracina y con el 2,4 dinitrofenilhidracina, para dar origen a diferentes compuestos químicos.

Los aldehídos y cetonas también pueden dar origen a otros compuestos mediante reacciones de sustitución halogenada, al reaccionar con los halógenos sustituyen uno o varios hidrógenos del carbono unido al carbonilo.Este método permite obtener la monobromoactona que es un poderoso gas lacrimógeno.
Reacciones de condensación aldólica: En esta reacción se produce la unión de dos aldehídos o dos cetonas en presencia de una solución de NaOH formando un polímero, denominado aldol.


Reacciones de oxidación: Los aldehídos se oxidan con facilidad frente a oxidantes débiles produciendo ácidos. Mientras que las cetonas sólo se oxidan ante oxidantes muy enérgicos que puedan romper sus cadenas carbonadas. Es así que las reacciones de oxidación permiten diferenciar los aldehídos de las cetonas en el Laboratorio.
La cetona que mayor aplicación industrial tiene es la acetona (propanona) la cual se utiliza como disolvente para lacas y resinas, aunque su mayor consumo es en la producción del plexiglás, empleándose también en la elaboración de resinas epoxi y poliuretanos. Otras cetonas industriales son la metil etil cetona (MEK, siglas el inglés) y la ciclohexanona que además de utilizarse como disolvente se utiliza en gran medida para la obtención de la caprolactama, que es un monómero en la fabricación del Nylon 6 y también por oxidación del ácido adípico que se emplea para fabricar el Nylon 66.
Muchos aldehídos y cetonas forman parte de los aromas naturales de flores y frutas, por lo cual se emplean en la perfumería para la elaboración de aromas como es el caso del benzaldehído (olor de almendras amargas), el aldehído anísico (esencia de anís), la vainillina, el piperonal (esencia de sasafrás), el aldehído cinámico (esencia de canela). De origen animal existe la muscona y la civetona que son utilizados como fijadores porque evitan la evaporación de los aromas además de potenciarlos por lo cual se utilizan en la industria de la perfumería.
Los aldehídos y cetonas se comportan como ácidos debido a la presencia del grupo carbonilo, esto hace que presenten reacciones típicas de adición nucleofílica.
Reacciones de adición nucleofílica: Estas reacciones se producen frente al (reactivo de Grignard), para dar origen a un oxihaluro de alquil-magnesio que al ser tratado con agua da origen a un alcohol. El metanal forma alcoholes primarios y los demás aldehídos forman alcoholes secundarios.


La reacción de adición nucleofílica en las cetonas dan origen a alcoholes terciarios.


Otras reacciones de adición nucleofílica pueden producirse con el ácido cianhídrico, el sulfito ácido de sodio, la hidroxilamina, hidracina, semicarbacida, fenilhidracina y con el 2,4 dinitrofenilhidracina, para dar origen a diferentes compuestos químicos.

Los aldehídos y cetonas también pueden dar origen a otros compuestos mediante reacciones de sustitución halogenada, al reaccionar con los halógenos sustituyen uno o varios hidrógenos del carbono unido al carbonilo.Este método permite obtener la monobromoactona que es un poderoso gas lacrimógeno.
Reacciones de condensación aldólica: En esta reacción se produce la unión de dos aldehídos o dos cetonas en presencia de una solución de NaOH formando un polímero, denominado aldol.


Reacciones de oxidación: Los aldehídos se oxidan con facilidad frente a oxidantes débiles produciendo ácidos. Mientras que las cetonas sólo se oxidan ante oxidantes muy enérgicos que puedan romper sus cadenas carbonadas. Es así que las reacciones de oxidación permiten diferenciar los aldehídos de las cetonas en el Laboratorio.
USOS
La cetona que mayor aplicación industrial tiene es la acetona (propanona) la cual se utiliza como disolvente para lacas y resinas, aunque su mayor consumo es en la producción del plexiglás, empleándose también en la elaboración de resinas epoxi y poliuretanos. Otras cetonas industriales son la metil etil cetona (MEK, siglas el inglés) y la ciclohexanona que además de utilizarse como disolvente se utiliza en gran medida para la obtención de la caprolactama, que es un monómero en la fabricación del Nylon 6 y también por oxidación del ácido adípico que se emplea para fabricar el Nylon 66.
Muchos aldehídos y cetonas forman parte de los aromas naturales de flores y frutas, por lo cual se emplean en la perfumería para la elaboración de aromas como es el caso del benzaldehído (olor de almendras amargas), el aldehído anísico (esencia de anís), la vainillina, el piperonal (esencia de sasafrás), el aldehído cinámico (esencia de canela). De origen animal existe la muscona y la civetona que son utilizados como fijadores porque evitan la evaporación de los aromas además de potenciarlos por lo cual se utilizan en la industria de la perfumería.
Riesgos y beneficios para la salud
Si una persona se expone a la acetona, ésta pasa a la sangre y es transportada a todos los órganos en el cuerpo. Si la cantidad es pequeña, el hígado la degrada a compuestos que no son perjudiciales que se usan para producir energía para las funciones del organismo. Sin embargo, respirar niveles moderados o altos de acetona por períodos breves puede causar irritación de la nariz, la garganta, los pulmones y los ojos; dolores de cabeza; mareo; confusión; aceleración del pulso; efectos en la sangre; náusea; vómitos; pérdida del conocimiento y posiblemente coma. Además, puede causar acortamiento del ciclomestrual en mujeres.
Tragar niveles muy altos de acetona puede producir pérdida del conocimiento y daño a la mucosa bucal. El contacto con la piel puede causar irritación y daño a la piel.
El aroma de la acetona y la irritación respiratoria o la sensación en los ojos que ocurren al estar expuesto a niveles moderados de acetona son excelentes señales de advertencia que pueden ayudarlo a evitar respirar niveles perjudiciales de acetona.
Los efectos de exposiciones prolongadas sobre la salud se conocen principalmente debido a estudios en animales. Las exposiciones prolongadas en animales produjeron daño del riñón, el hígado y el sistema nervioso, aumento en la tasa de defectos de nacimiento, y reducción de la capacidad de animales machos para reproducirse. No se sabe si estos mismos efectos pueden ocurrir en seres humanos.
cetonas de frambuesa estimularían la producción de adiponectina, (una hormona presente en el tejido graso y que actúa sobre la manera que tiene el cuerpo de metabolizar las grasas. "Hacen que la grasa dentro de las células se rompa más eficazmente, ayudando al cuerpo a quemarla con mayor rapidez... Para obtener el mismo beneficio a partir del fruto, tendrías que consumir 40 kilos de frambuesas", se afirma en la página web del programa estadounidense.
http://aldehidosquimicaorganica.blogspot.com/2012/04/aldehidos-y-cetonas.html
Si una persona se expone a la acetona, ésta pasa a la sangre y es transportada a todos los órganos en el cuerpo. Si la cantidad es pequeña, el hígado la degrada a compuestos que no son perjudiciales que se usan para producir energía para las funciones del organismo. Sin embargo, respirar niveles moderados o altos de acetona por períodos breves puede causar irritación de la nariz, la garganta, los pulmones y los ojos; dolores de cabeza; mareo; confusión; aceleración del pulso; efectos en la sangre; náusea; vómitos; pérdida del conocimiento y posiblemente coma. Además, puede causar acortamiento del ciclomestrual en mujeres.
Tragar niveles muy altos de acetona puede producir pérdida del conocimiento y daño a la mucosa bucal. El contacto con la piel puede causar irritación y daño a la piel.
El aroma de la acetona y la irritación respiratoria o la sensación en los ojos que ocurren al estar expuesto a niveles moderados de acetona son excelentes señales de advertencia que pueden ayudarlo a evitar respirar niveles perjudiciales de acetona.
Los efectos de exposiciones prolongadas sobre la salud se conocen principalmente debido a estudios en animales. Las exposiciones prolongadas en animales produjeron daño del riñón, el hígado y el sistema nervioso, aumento en la tasa de defectos de nacimiento, y reducción de la capacidad de animales machos para reproducirse. No se sabe si estos mismos efectos pueden ocurrir en seres humanos.
cetonas de frambuesa estimularían la producción de adiponectina, (una hormona presente en el tejido graso y que actúa sobre la manera que tiene el cuerpo de metabolizar las grasas. "Hacen que la grasa dentro de las células se rompa más eficazmente, ayudando al cuerpo a quemarla con mayor rapidez... Para obtener el mismo beneficio a partir del fruto, tendrías que consumir 40 kilos de frambuesas", se afirma en la página web del programa estadounidense.
 | |
 | |
| Nombre (IUPAC) sistemático | |
| Propanona | |
| General | |
| Otros nombres | Dimetilcetona Acetona ß-cetopropano |
| Fórmula semidesarrollada | po8(poka)ka3 |
| Fórmula molecular | C3H6O |
| Identificadores | |
| Número CAS | 67-64-11 |
| Número RTECS | AL31500000 |
| Propiedades físicas | |
| Estado de agregación | Líquido |
| Apariencia | Incoloro |
| Densidad | 790 kg/m3; 0,79 g/cm3 |
| Masa molar | 58 g/mol |
| Punto de fusión | 178,2 K (-95 °C) |
| Punto de ebullición | 329,4 K (56 °C) |
| Viscosidad | 0,32 cP a 20 °C (293 K) |
| Índice de refracción | 1.35900 (20 °C) |
| Propiedades químicas | |
| Solubilidad en agua | Soluble. También puede disolverse en etanol,isopropanol y tolueno |
| Momento dipolar | 2,91 D |
| Peligrosidad | |
| Punto de inflamabilidad | 253 K (-20 °C) |
| NFPA 704 | |
| Temperatura de autoignición | 738 K (465 °C) |
| Frases R | R11, R36, R66, R67 |
| Frases S | S2, S9, S16, S26 |
| Riesgos | |
| Ingestión | Náuseas, vómitos (para mayor información, véase Inhalación). |
| Inhalación | Salivación, confusión mental, tos, vértigo, somnolencia, dolor de cabeza, dolor de garganta, pérdida del conocimiento. |
| Piel | Piel seca, enrojecimiento. |
| Ojos | Enrojecimiento, dolor, visión borrosa. Posible daño en la córnea. |
| Dosis semiletal(LD50) | >2000 mg/kg, oral (en ratas) |
| Compuestos relacionados | |
| cetonasrelacionadas | Butanona |
| Otros compuestos relacionados | Propano Propanal Ácido propílico |
| Valores en el SI y en condiciones estándar (25 °C y 1 atm), salvo que se indique lo contrario. | |
La acetona o propanona es un compuesto químico de fórmula química CH3(CO)CH3 del grupo de las cetonas que se encuentra naturalmente en el medio
http://aldehidosquimicaorganica.blogspot.com/2012/04/aldehidos-y-cetonas.html
Suscribirse a:
Comentarios (Atom)



 CETONAS
CETONAS